多发性硬化症(MS)是一种慢性免疫介导的中枢神经系统退行性疾病,自身免疫性疾病的一种,源于免疫细胞对中枢神经系统的攻击,导致脱髓鞘病变。全球约230万MS患者[1],美国约72万多患者[2]。MS的早期表现为中枢神经系统内反复急性局灶性炎症发作,导致神经功能障碍。随着急性炎症在几周内消退,神经症状可能部分或完全消退。
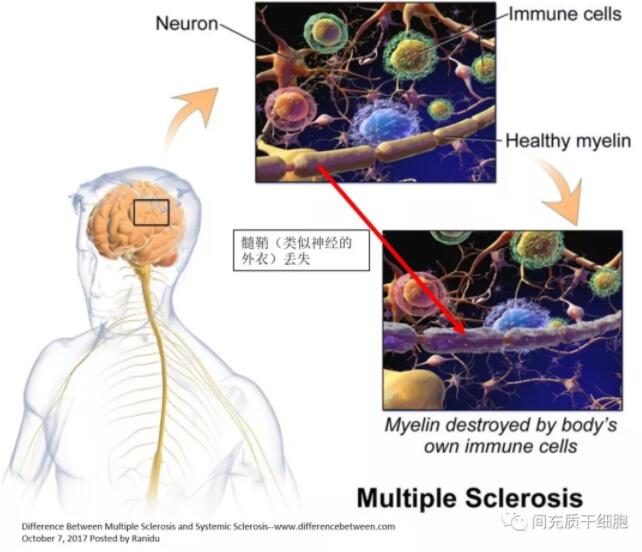
复发缓解型MS(RRMS)被认为是最常见的MS形式,患者在两次复发之间经历部分恢复。由于反复损害中枢神经系统,患者最终会导致残疾[3]。大约80%的患者具有复发缓解型(RRMS),其中三分之二将在发病10-15年后发展为继发性进展型;大约20%的患者从发病开始就发展为进行性形式,即原发性进行性多发性硬化症(PPMS)[4]。
造血干细胞(HSCs)移植治疗MS
鉴于免疫系统在MS发病机制中的核心作用,通过自体造血干细胞移植(HSCT)重建免疫系统,改善侵袭性MS患者的预后[5, 6]。涉及764名晚期难治性患者的meta分析,AHSCT后2年的进展率为17.1%,5年的进展率为23.3%;RRMS患者的2年进展率显著降低,NEDA患者在2年达到83%(70-92%),在5年达到67%(59-70%)[7]。另一涉及732名患者的meta分析,显示接受低强度和中等强度造血干细胞移植的患者的无进展生存率(PFS)为80%,RRMS患者的PFS为85%[8]。一项多中心研究随访在1995年至2006年间接受自体造血干细胞移植治疗的13个国家的281名进展性MS患者,平均随访6.6年(0.2-16年),5年无进展生存率为46%,总生存率为93%[9]。
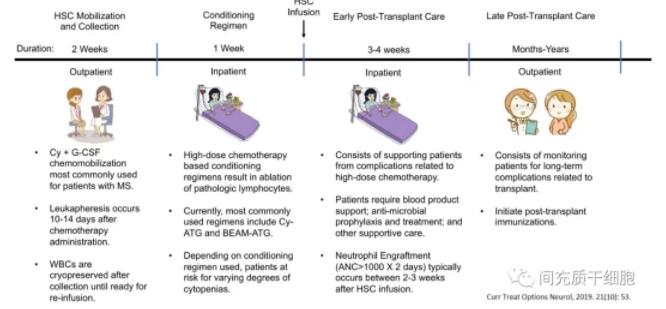
自体造血干细胞移植治疗程序分为5个部分[10]:(1)造血干/祖细胞(HSPC)动员,(2)HSPC采集,(3)患者准备,(4)造血干细胞输注,(5)移植后护理(见下图)。
多项临床研究证明了利用HSCT可以控制MS活动,病情的改善可以得到持久维持[9, 11-14]。HSCT的益处在其他疾病活动指标中也很明显,包括更少的复发,改善MRI病变负荷,更高比例的患者保持无疾病活动证据,以及更好的生活质量。然后HSCT是一种资源密集型治疗,需要专门的医疗和护理专业知识以及专门的医院基础设施,以最大限度地降低其风险。
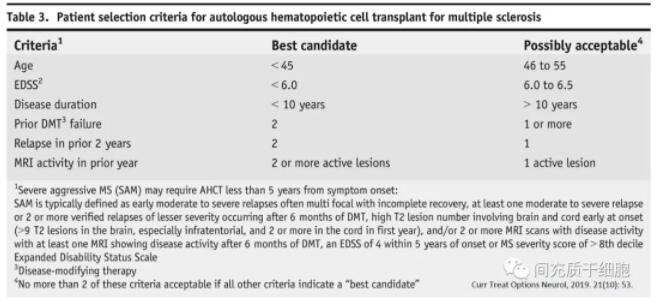
适合造血干细胞移植治疗MS的患者条件:
2019年Harold Atkins医生在《JAMA》发表论文的论述中提到几个需要解决的问题[15]:在MS过程中,什么时候HSCT是最佳使用的?在控制MS中平衡毒性和有效性的最佳移植预处理方案是什么?HSCT是否应该更广泛地应用于复发率较低的患者?但是,不少专家认为通过体外CD34+分选的造血干细胞尚未被证明能够改善MS患者的预后[16-18]。
间充质干细胞(MSCs)移植治疗MS
动物实验的研究成果证明MSC通过抑制免疫细胞的异常激活,减少免疫细胞对神经系统的攻击,减少神经中枢白细胞浸润,从而改善MS的病情[19]。将脐带MSC通过静脉输入到患实验性自身免疫性脑脊髓炎(EAE)的食蟹猴体内,磁共振成像和临床体征表明MSC治疗后脱髓鞘明显减少,其中的MSC治疗作用机制包括其调节细胞因子分泌和影响T细胞系功能分化的免疫调节功能[20, 21]。经MSC治疗的患者在EDSS评分和复发率均明显低于对照组,而且伴随着治疗组患者体内的Th1免疫转变为Th2免疫[21]。
预先用白介素-1β培养刺激MSC,可以增强MSC的抑制T细胞激活的能力[22]。在EAE和MS中,Th1和Th17亚群的活化被认为与疾病活动有关[23, 24]。先发现MSC可以抑制Th1的激活[25],而后发现MSC同样可以抑制EAE疾病模型动物的Th17的激活[26, 27]。也有研究显示MSC抑制Th1的激活,但是促进Th17的激活增殖[28, 29]。MSC对Th17细胞的作用效果不一致的原因,可能与CD4+T细胞当时所处的状态有关。当在CD4+T细胞激活刺激因素存在的早期加入MSC培养时,MSC表现出典型的抑制表型;当CD4+T细胞已经被激活之后,再加入MSC时,MSC对Th17细胞表现出相反的促进作用[30]。这些结果表明,根据治疗应用时间和效应T细胞激活水平,体内治疗使用MSC可能会对疾病活动产生相反的影响。
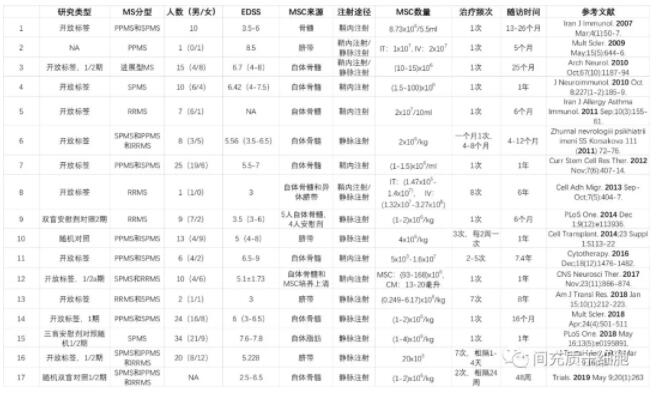
有一篇综述汇总了目前MSC治疗MS的临床研究情况,包括使用不同的给药途径、MSC细胞数量、MSC来源等情况(下表)[31]。
MMP-9能增加血脑屏障的通透性,淋巴细胞过度表达MMP-9从而加剧血脑屏障的破坏[32],抑制MMP-9的活性,能改善血脑屏障,从而减少大脑损伤[33]。由于MSC也分泌低水平的MMP-9,明显存在利弊,利在于MMP-9增加血脑屏障,有利于MSC通过血脑屏障而发挥作用,弊在于血脑屏障通透性增强,免疫细胞也会进入大脑对神经细胞进行攻击。因此有专家担心MMP-9的双刃剑作用会掩盖MSC的积极治疗作用,MSC联合MMPs抑制剂将会取得更好的治疗效果[34]。然而,尽管存在上述问题,不少临床研究已经证实了MSC的有益治疗作用[4, 31, 35]。
有病例报道,一位27岁女性,患有脑炎和视神经炎,随后在埃及Kaser Al-Aini医院进行自体骨髓间充质干细胞鞘内注射,第三次输注6小时后,她失去意识,发热,脑MRI显示急性双颞叶和左侧小脑病变,诱发了急性脑脊髓炎样脱髓鞘疾病[36]。这家医院在在抽取患者骨髓细胞后,通过贴壁方法去除悬浮的细胞,然后收集贴壁细胞,通过流式细胞仪方法检测CD44的表达,结果未予在文章中显示,把这群CD44+细胞当作MSC来给病人鞘内注射治疗。这就是典型的借MSC的名义进行虚假宣传和治疗。
静脉或鞘内注射的自体MSC在治疗MS方面具有潜在的效用,并且在7至15例进展性MS患者组中分别进行了几项小型的临床研究[37-40]。这些临床研究没有报告严重的不良事件,但临床结果喜忧参半。在平均随访19个月后,残疾改善1例,稳定4例,恶化5例[37]。两项研究报告12个月时进展性残疾状况量表(EDSS)评分平均改善0.8分[38]。随访6个月时7例患者中5例EDSS得到较明显的改善[39]。在11例继发性进行性MS伴视觉障碍的患者中,报告在6个月时视力、对比敏感度和视觉诱发电位潜伏期略有改善[40]。这些研究为未来的大样本随机对照试验铺平了道路。
大多数报道的试验都是非对照的开放标签的I/II期研究,给药方式为鞘内注射或静脉注射,给药细胞的数量以及给药次数在不同的试验中有所不同。这些试验中包括的少量患者和试验设计之间的差异构成了数据解释方面的限制,并证明了进一步随机多中心对照的大样本试验的必要性。比较有临床指导意义的是2014年和2018年报道的RCT临床试验。2014年的一项双盲随机安慰剂对照II期RCT临床试验,9名接受静脉注射(1-2)x106MSC/kg体重的患者,观察到免疫学变化与抑制了促炎T细胞的特征相一致[41]。2018年西班牙开展的多中心三盲RCT的1/2期临床试验,MSC来源于MS患者的脂肪组织;34例患者被随机分组(安慰剂11例,低剂量10例和高剂量9例),其中MSC低剂量为1x106/kg、高剂量为4x106/kg;自体脂肪MSC产品的单次输注,并随访12个月;在治疗组中只观察到一种严重的不良事件(尿路感染,被认为与研究治疗无关),其余未见明显的不良反应,但是治疗效果的测量值显示了疗效的不确定趋势[42]。
MSC治疗MS的作用机制示意图:
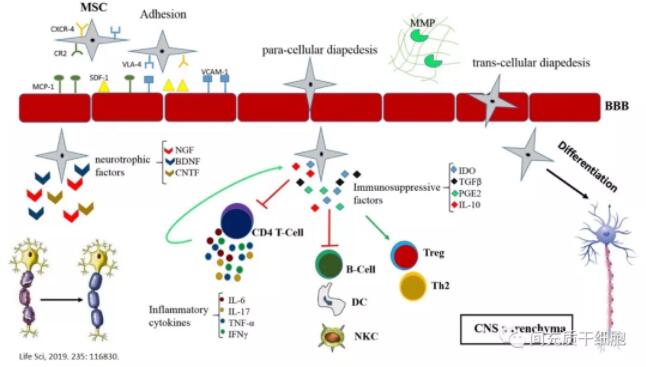
通过大样本回顾分析,发现炎性攻击和导致疾病进展的机制之间缺乏关联表明,轴突易损性或对退化的抵抗力可能受到独立的基因控制的影响;通过促进向第二次进展型MS的转化来促进病情恶化,这种促进作用是否与与炎症的相互作用有关仍不明确;但强调预防或延迟进展期是未来治疗的理想目标[3]。MSC具有强大的免疫抑制功能,抑制免疫异常激活,减少炎症;同时MSC能分泌众多的营养性因子,这些营养性因子有利于神经细胞的修复。但是MSC能否让脱髓鞘的神经纤维,再重新形成新的髓鞘?拭目以待,相信持续的深入研究能回答这个问题。
补充内容1
健康骨髓MSC和MS患者骨髓MSC的差异
MS患者的骨髓中分离出MSC,对照组MSC从无MS患者的全髋关节置换术中获得的骨髓中分离出来的,两组MSC在增殖、分化潜能和细胞表面抗原表达方面相似[43]。而且MS患者分离的骨髓MSCs在体外分化、TLR表达、免疫抑制能力等方面表现出与健康者骨髓MSC相同的特性[44]。来自健康人和MS患者的牙周组织MSC在早期(2代)表现出相似的表面抗原标记表达和细胞增殖率,还有成骨、成脂、软骨和神经源性分化能力[45]。
但是也有团队发现从进展型MS患者分离的骨髓MSC在体外增殖能力降低、细胞培养容易过早衰老和神经保护能力降低[46]。抗氧化剂在衰老和神经保护中有作用,但是从MS患者骨髓中分离培养的MSC,其抗氧化剂超氧化物歧化酶1(SOD1)和谷胱甘肽S-转移酶P(GSTP)的分泌减少,并且与MS进展期的持续时间呈负相关,这说明MS患者的MSC抗氧化能力下降[47]。
补充内容2
多发性硬化症(MS)和系统性硬化症(SS)的差别
是以硬化症来命名,都是自身免疫性疾病,多发性硬化症(MS)和系统性硬化症(SS)是不是同一种病?
多发性硬化症(MS)是一种慢性免疫介导的中枢神经系统退行性疾病,核心病理基础是神经的脱髓鞘病变。而系统性硬化症(SS)是一种多系统疾病,其器官损害的特征是纤维化、微血管闭塞和血管内膜增生。简单来说,MS是神经损伤类疾病,而SS组织器官损伤类疾病。虽然非常罕见,但是MS和SS是可以同时出现在一个倒霉透顶的病人身上[48, 49]。当然,SS属于自身免疫性疾病,也适合用MSC治疗[50]。


